Henrique Sonobe¹ ; Paulo Bohrer²
¹Consultor Técnico Industrial na Nalco Water
²Consultor Técnico Industrial e Líder do time de consultores da Nalco Water.
1. Introdução
A água é um recurso finito, essencial para o desenvolvimento humano e seu consumo tem crescido nos últimos anos devido ao aumento populacional e consequentes aumentos de consumos agrícolas e industriais.
Nas regiões áridas e semiáridas, a água se tornou um fator limitante para o desenvolvimento urbano, industrial e agrícola. Mesmo em regiões com recursos hídricos abundantes, a elevada demanda torna a água insuficiente para todos os usos e leva a restrições de consumo, que afetam o desenvolvimento econômico e a qualidade de vida. (Hespanhol, 2002).
O cenário de escassez de água tem gerado constante preocupação e levado o setor industrial a buscar alternativas para reduzir o consumo de água e investir em tecnologias para sua reutilização. Entre as alternativas de reutilização de água em indústrias, a água de reposição de torres de resfriamento se destaca. Segundo Puckorius et al. (2001), sistemas de resfriamento de águas representam o terceiro maior consumo de água de reuso nos Estados Unidos e vêm crescendo a cada ano.
Contudo o reuso em torres de resfriamento não deve ser banalizado. Deposições, incrustações, deposições e fouling biológico são agravados em sistemas de resfriamento quando a água de reposição não tem boa qualidade e o programa de tratamento da água de resfriamento é ineficiente. Este artigo se propõe a revisar os principais problemas em sistemas de resfriamento e estabelecer diretrizes para a realização de reuso de efluentes de forma segura nesses sistemas.
2. Sistemas de resfriamento
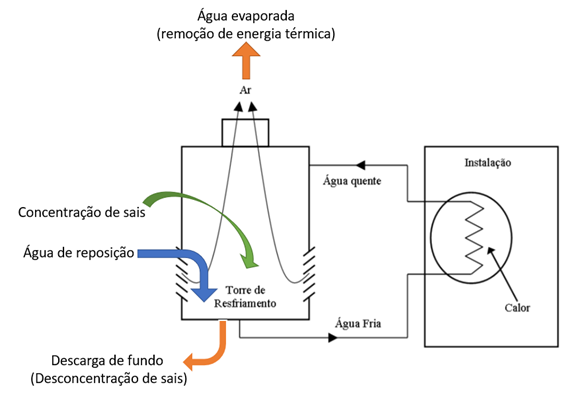
As torres de resfriamento são sistemas de resfriamento evaporativo que usam a água para absorver o calor do processo e, em seguida, transferem o calor por evaporação (Figura 1). Conforme a água de resfriamento é recirculada, a água de reposição é necessária para repor a água perdida durante a evaporação.
Como a água é evaporada, sólidos suspensos e sais dissolvidos permanecem na água recirculada que sofre um processo de concentração. Esses sólidos e sais devem ser removidos ou tratados para evitar o seu acúmulo no equipamento. A remoção desses sólidos é realizada descarregando uma porção pré-estabelecida da água de resfriamento, referida como água de purga ou vazão de descarga. A vazão de água de reposição dividida pelo vazão de descarga é denominada ciclos de concentração. Ciclos de concentração é também é a razão da concentração de uma substância específica na água de recirculação (descarga) pela concentração da mesma substância na água de reposição.
Figura 1 – Representação esquemática de uma torre de resfriamento.
3. Principais problemas em torres de resfriamento
3.1. Deposição
O processo chamado de deposição (fouling) ocorre quando material em suspensão se acumula em sistemas de resfriamento. Materiais sedimentáveis podem vir de fontes externas tais como poeira ao redor de uma torre de resfriamento e turbidez da água de reposição, ou de fontes internas tais como produtos de corrosão, precipitação de espécies dissolvidas, vazamentos do processo, ou criado por microrganismos (lodo biológico).
3.2. Fouling microbiológico
O crescimento biológico pode produzir depósitos indesejáveis de biofilme, que podem interferir na transferência de calor, causar corrosão microbiologicamente induzida por ácido ou subprodutos corrosivos, pode impedir que os inibidores de corrosão protejam as superfícies metálicas e estabelecer corrosão sob o depósito. Filmes biológicos podem crescer rapidamente e obstruir trocadores de calor, criar filme no recheio de torres de resfriamento ou entupir bicos / sprays de distribuição de água da torre de resfriamento.
Um dos principais problemas com o uso da água de reuso em torres de resfriamento está relacionado à ocorrência de crescimento biológico.
- Incrustação
Incrustação é um processo químico em que sólidos dissolvidos precipitam formando minerais insolúveis. A formação de incrustação ocorre quando sais minerais precipitam da fase água porque a solubilidade do mineral em particular foi excedida. A incrustação normalmente forma uma camada bastante aderente de minerais que é ligada fortemente a ela própria e às superfícies dos metais. Os constituintes primários que resultam em incrustação são cálcio, magnésio, sulfato, alcalinidade, fosfato e sílica. Em sistemas de resfriamento abertos, são comuns incrustações de fosfato de cálcio, carbonato de cálcio, sulfato de cálcio, sílica e silicato de magnésio.
As incrustações, devido a sua baixa condutividade térmica quando comparadas com as dos materiais metálicos, comprometem drasticamente a troca térmica e desta forma é imperativo que sejam evitadas (Machado, 2005). Os constituintes com potencial para formar incrustações devem ser avaliados e controlados por tratamento químico e/ou adequação do número de ciclos de concentração.
3.4. Corrosão
Quimicamente, corrosão é uma reação de óxido-redução (redox). Assim ela não é simplesmente o metal se dissolvendo na solução, mas envolve a transferência de elétrons, a reação dos produtos da reação e a migração de íons. A força propulsora para essas reações é a diferença de potencial elétrico entre elas; a diferença de potencial entre o anodo e catodo leva à reação de corrosão.
Dantas (1992) compilou os fatores que influenciam na corrosão, dividindo-os em fatores químicos e fatores físicos:
Fatores químicos
- pH: Metais solúveis em ácido – óxidos ficam mais solúveis à medida que baixa o pH, aumentando a corrosão. Metais anfóteros – óxidos ficam solúveis em pH alto ou baixo. Uma proteção é favorecida em pH intermediário. Metais nobres – óxidos são insolúveis com qualquer pH, sendo inertes à corrosão.
- Sais Dissolvidos: Cloreto e sulfato podem penetrar camadas passivas de óxido e promover ataque localizado. Cálcio, magnésio e alcalinidade podem precipitar-se formando depósitos protetores.
- Gases Dissolvidos: CO2 – baixa o pH e promove o ataque ácido. O2– despolariza a reação de corrosão no cátodo, áreas deficientes em oxigênio tornam-se anódicas (células de aeração diferencial). Nitrogênio – agrava a corrosão por cavitação. Amônia – corrói seletivamente os metais de cobre. H2S – promove o ataque ácido; forma depósitos que promovem corrosão galvânica. Cl2– promove ataque ácido, remove filmes de inibidor de corrosão.
- Sólidos Suspensos: Lama, areia, sujeira, etc. sedimentam-se formando depósitos, podendo promover corrosão por célula de aeração diferencial.
- Microrganismos: Promovem ataque ácido, corrosão por célula de aeração diferencial, despolarização catódica e corrosão galvânica.
Fatores Físicos
- Áreas Relativas: Em um par galvânico, a corrosão aumenta com o aumento da razão entre a área catódica e a área anódica.
- Temperatura: O aumento da temperatura favorece a despolarização do oxigênio, abaixa a sobrevoltagem de hidrogênio e a corrosão aumenta. Áreas de temperatura mais elevada tornam-se anódicas em relação a outras áreas. Temperaturas mais elevadas mudam os potenciais dos metais (p. ex., galvanização inversa).
- Velocidade: A alta velocidade promove a corrosão por erosão e remove filmes passivantes. A baixa velocidade aumenta a sedimentação e a corrosão por células de aeração diferencial diminui a quantidade de inibidor de corrosão que atinge e passiva as superfícies metálicas.
- Transferência de Calor: Favorece a despolarização por oxigênio através do “ efeito de parede quente” . Favorece a formação de células de aeração diferencial, aumentando a precipitação e sedimentação dos sólidos.
- Metalurgia: Irregularidades da superfície, cortes, arranhões, etc. favorecem a formação de pontos anódicos. Tensões – tensões internas promovem a formação de pontos anódicos. Microestrutura – inclusões metálicas, precipitação em fronteiras granulares, grãos contíguos diferentes, etc. promovem a formação de células galvânicas.
Dantas (1992) compilou também os diversos tipos de corrosão:
- Aeração diferencial sob depósitos: É ocasionada por depósitos porosos (matéria orgânica, biofilme, poeira, SST, lama) que criam uma pilha devida à diferença de aeração acima e abaixo do depósito. As partes menos aeradas, que se encontram sob os depósitos, são os anodos, onde ocorre a oxidação (corrosão) e as partes mais aeradas, são os catodos, onde ocorre a redução (proteção). Os produtos de corrosão oriundos do anodo se avolumam sob o depósito inicial, formando os tubérculos. Depois de formados, seu crescimento independe das concentrações de inibidores de corrosão, existentes na água de refrigeração, o que evidencia a gravidade da sua presença para os metais dos sistemas.
- Aeração diferencial por frestas: Em frestas formadas entre metais iguais ou de naturezas diferentes o acesso de eletrólito para o seu interior é dificultado e desta forma podem propiciar a formação de uma pilha devida á concentração iônica salina ou de oxigênio diferencial que se estabelece entre o interior e o exterior da fresta, sendo a pilha por aeração diferencial predominante sobre a pilha de concentração iônica diferencial.
- Pilhas Galvânicas: Decorrem pelo contato entre metais com potenciais diferentes. As pilhas com maior diferença de potencial, mais encontradas nestes equipamentos são cobre-ferro, onde o cobre é o catodo e o ferro, o anodo. O metal atacado será o ferro, com maior tendência a sofrer corrosão, e a maior profundidade de ataque é na junção com o cobre.
- Corrosão Ácida: Decorre da utilização de água de alimentação com valores de pH menores que 6 ou absorção pela água, na torre, de gases ácidos como CO2, SO2 e SO3, normalmente, provenientes de chaminés de caldeiras. A corrosão ácida se apresenta na forma uniforme na superfície do aço-carbono e na forma localizada na superfície do cobre e suas ligas, onde pequenos alvéolos aparecem com diâmetro superior à sua profundidade.
- Corrosão Alcalina: Acontece quando o valor do pH da água de refrigeração excede 9,0, atacando os seguintes metais: alumínio, zinco, estanho e antimônio com a formação dos produtos de corrosão aluminatos, zincatos, estanatos e antimoniatos de sódio.
- Corrosão pelos cloretos: Os íons cloreto presentes nas águas de resfriamento, dependendo da sua concentração, interferem nas áreas anódicas, onde se forma um óxido de ferro cúbico protetor, e nas áreas catódicas, onde se formam as camadas aderentes e contínuas dos inibidores de corrosão, associados a cálcio e zinco. Em ambas as áreas os íons cloreto tem a capacidade de romper os filmes protetores com o aparecimento de pites. A corrosão pelos cloretos é acelerada em meio ácido, nos metais aço-carbono, aço inox 304, cobre e suas ligas, etc.
Segundo Gentil (2003), o cloreto é um dos sais que mais influenciam a corrosão e seu efeito deve-se ao fato de este sal ser um eletrólito forte, ocasionando, portanto, aumento de condutividade, que é fundamental no mecanismo eletroquímico de corrosão.
- Corrosão pelo Gás Sulfídrico: Pode estar presente no meio ambiente e na torre, é absorvido pela água passando a ácido sulfúrico. Este ácido é extremamente reativo, atacando todos os metais utilizados em sistemas de refrigeração, com a formação dos seus sulfetos metálicos. No caso do aço-carbono, o sulfeto de ferro formado cria um par galvânico, onde ele é o catodo e o ferro não atacado, o anodo, estabelecendo-se então, um novo tipo de corrosão. O sulfeto de ferro formado nucleia na forma de grãos ou agulhas de cor negra.
- Corrosão pela Amônia: Amônia, em meio aerado, ataca o cobre e suas ligas, formando o complexo azul.
- Corrosão Por Tensão Fraturante: Este tipo de corrosão se refere ao aparecimento de trincas, causadas pelas presenças simultâneas de esforço de tração e de um meio corrosivo específico ao metal fraturado. Este tipo de corrosão pode ser intercristalina (as trincas propagando-se nos limites dos grãos da rede cristalina) ou intracristalina (propagando-se sem preferência para os limites dos grãos), podendo fraturá-los ou secioná-los. Os dois casos mais comuns de corrosão por tensão fraturante são: aços inoxidáveis, na presença de cloretos e cobre, e suas ligas na presença de amônia. Aços inoxidáveis 304, 316 e variantes, como os estabilizados com nióbio e titânio são susceptíveis à corrosão por tensão fraturante na presença de halogenetos e entre estes, principalmente, dos íons cloretos. O cobre e suas ligas podem sofrer corrosão por tensão fraturante, pela amônia ou pelas aminas que se podem degradar em amônia.
- Corrosão Seletiva – Dezincificação e Grafítica: Resulta da remoção de um dos elementos de uma liga, por meio de um agente corrosivo, específico. Latões (dezincificação) e o ferro fundido cinzento (grafítica) são as ligas mais susceptíveis a este tipo de corrosão.
4. Reuso de efluentes como a água de reposição de torres de resfriamento.
A composição química da água de reposição da torre de resfriamento é de suma importância para o controle e otimização do sistema, influenciando diretamente na taxa de purga, os ciclos de concentração e, consequentemente, na taxa de reposição da torre. Quanto melhor a qualidade da água de reposição, maior será o ciclo de concentração e menor será o consumo de água.
Os efluentes, em geral, possuem elevada concentração de sólidos dissolvidos. Segundo EPA (1992), em água de reuso a partir de esgoto doméstico, a concentração de SDT fica em torno de duas a cinco vezes a concentração na água potável. Portanto, a qualidade da água recuperada deve ser avaliada, juntamente com o potencial de incrustação, garantindo a viabilidade do reuso.
A grande maioria dos projetos de reuso foca o tratamento na redução de sólidos suspensos e matéria orgânica sem, no entanto, se preocupar, com os limites de controle para as concentrações de sais dissolvidos. Como regra geral, as concentrações de cloretos e sulfatos na água de reuso já se encontram acima dos limites de controle para águas de resfriamento provocando sérios problemas de corrosão. O uso de coagulantes à base de ferro ou de alumínio nas ETEs, se indevidamente aplicados, geram residuais destes metais muito acima dos valores toleráveis para chillers e torres de resfriamento. Se cal for utilizada como regulador de pH da água na ETE, os limites de dureza de cálcio são ultrapassados e incrustações de natureza rígida se formam nos trocadores de calor das instalações de utilidades, reduzindo drasticamente seu desempenho térmico (Bohrer, 2019).
Limites de valores de concentração dos constituintes da água de reuso têm sido discutidos. Em 1992, a EPA sugeriu os limites na água de alimentação mostrados na Tabela 1. Entretanto, em seu guia de 2012, a EPA recomenda a avaliação da qualidade de acordo com seu potencial de incrustação e não indica limites na água de reposição de sistemas de resfriamento industrial. Eslamian (2016) também faz recomendações quanto a qualidade da água de reposição. Nota-se que os limites apresentados na Tabela 1 são parecidos, com diferenças significativas apenas em relação a alcalinidade e dureza.
Tabela 1 – Limites de concentração de diferentes parâmetros em águas de reposição segundo a EPA (1992) e Eslamian (2016).
| Parâmetro | Unidade | EPA (1992) | Eslamian (2016) |
| Cloretos | mg Cl- /L | 500 | 500 |
| Sólidos Totais Dissolvidos (STD) | mg/L | 500 | 500 |
| Dureza | mg CaCO3/L | 650 | 130 |
| Alcalinidade | mg CaCO3/L | 350 | 20 |
| pH | 6,9 – 9,0 | – | |
| DQO | mg/L | 75 | 75 |
| Sólidos Suspensos Totais (SST) | mg/L | 100 | 100 |
| Turbidez | NTU | 50 | – |
| DBO5 | mg/L | 25 | – |
| MBAS | mg/L | 1 | 1 |
| Nitrogênio Amoniacal | mg N/L | 1 | – |
| Fosfatos | mg PO4/L | 4 | – |
| Sílica | mg SiO2/L | 50 | 50 |
| Alumínio | mg Al/L | 0,1 | 0,1 |
| Ferro | mg Fe/L | 0,5 | 0,5 |
| Manganês | mg Mn/L | 0,5 | 0,5 |
| Cálcio | mg Ca/L | 50 | 50 |
| Cálcio | mg CaCO3/L | 125 | – |
| Magnésio | mg Mg/L | 0,5 | – |
| Bicarbonatos | mg CaCO3/L | 24 | 24 |
| Sulfatos | mg SO4/L | 200 | 200 |
A Nalco Water, como especialista em tratamento de águas de resfriamento, estabelece limites de concentração na bacia das torres de resfriamento, conforme Tabela 2.
Tabela 2 – Limites de Controle dos principais contaminantes em águas de resfriamento.
| Contaminante | Unidade | Limite de Controle |
| pH | 7,0 à 8,5 | |
| Alcalinidade Total | mg CaCO3 /L | 50 a 500 |
| Dureza de Cálcio | mg CaCO3 /L | 50 a 500 |
| Dureza de Magnésio | mg CaCO3 /L | 50 a 100 |
| Cloretos | mg Cl /L | < 300 * |
| Sulfatos | mg SO4 /L | < 250 |
| Sílica Solúvel | mg SiO2 /L | < 150 |
| Ferro Total | mg Fe /L | < 5,0 |
| Alumínio Total | mg Al /L | < 2,0 |
| Turbidez | NTU | < 20 |
| Matéria Orgânica | mg/L | < 50 |
| SST | mg/L | < 20 |
* Em presença de equipamentos e tubos de aços inoxidáveis poderá ser inferior à 50 ppm.
Comparando os parâmetros da água de reposição da Tabela 1 com os limites de controle estabelecidos pela Nalco Water é possível verificar incompatibilidades em relação a cloreto, sulfato, sólidos suspensos totais e turbidez, pois os valores limites da água de reposição estão demasiadamente próximos ou acima do limite de controle recomendado, ou seja, se a água de reposição tiver as características apontadas, o ciclo de concentração seria extremamente baixo, demandando uma vazão de purga excessiva. Portanto, entende-se que os valores desses parâmetros devem ser revisados visando a segurança da operação de reuso de efluente em torres de resfriamento.
A remoção ou redução de sais dissolvidos da água de reuso pode, portanto, ser necessária para viabilizar tecnicamente sua utilização em torres de resfriamento. O uso de água de reuso sem a avaliação correta pode tornar o projeto inviável financeiramente devido a falhas em equipamentos, aumento de manutenção, redução da produção, paradas de fábrica e, consequentemente, menor lucro.
A remoção ou redução de sais dissolvidos pode exigir alterações no processo produtivo ou processos unitários adicionais. A troca de químicos por outros que não tenham íons agressivos, como Cl– e SO42-, em sua composição é uma estratégia interessante para viabilizar o reuso de efluentes quando esses estão presentes em excesso. Por exemplo, a troca do ácido clorídrico por ácido fosfórico e a troca de sulfato de alumínio por coagulantes orgânicos.
Em relação a remoção de íons, processos como a osmose reversa podem ser necessários. Entretanto, quando os custos com a água são baixos, o investimento adicional numa planta de osmose reversa pode não apresentar um pay-back atrativo e, consequentemente, inviabilizar financeiramente o projeto. Uma alternativa neste caso é a remoção parcial dos sólidos dissolvidos mediante a dessalinização de apenas parte da corrente de água de reuso. Assim, uma água composta por parte de água dessalinizada e outra por água tal qual obtida na ETE pode tornar o investimento menor, proporcionando atratividade financeira para o projeto (Bohrer, 2019). Na mesma linha, uma mistura entre a água de reuso e a água potável pode tornar a água de reposição resultante apropriada para o uso nos sistemas de resfriamento sem a necessidade de grandes investimentos e com retornos financeiros e ambientais positivos.
Quando água de reuso é utilizada como make-up de torres de resfriamento é necessária a adequação no programa de tratamento químico (anti-incrustantes, biocidas, dispersantes, inibidores de corrosão, etc) e recomendada a automação do sistema e alteração nos controles realizados com o intuito de minimizar os principais problemas causados em sistemas abertos com recirculação (incrustação, depósitos, corrosão e proliferação microbiológica). A Nalco Water possui o programa adequado em sua linha de produtos para possibilitar o reuso de efluentes, assim como profissionais qualificados para avaliação da necessidade de cada projeto, em específico.
5. Conclusão
A busca por alternativas para reduzir o consumo de água nas indústrias tem crescido nos últimos anos. A água de reuso é uma excelente fonte alternativa de água, especialmente em um cenário de escassez hídrica. Por normalmente ter mais sólidos suspensos e sais dissolvidos, a água de reuso como água de make-up de torres de resfriamento pode levar a redução dos ciclos de concentração para adequação da quantidade de íons no sistema de resfriamento. Pelo mesmo motivo, a água de reuso em sistemas de resfriamento demanda mais atenção para evitar problemas com deposição, fouling microbiológico, incrustação e corrosão.
Para o sucesso de um projeto de reuso de água em torres de resfriamento é necessário que a água a ser reusada tenha boa qualidade. Recomenda-se que o projeto de reuso contemple:
- a caracterização físico-química da água a ser reutilizada, avaliando os íons críticos e a possibilidade de removê-los do processo produtivo;
- Se necessário, a definição de tecnologias de tratamento para a água a ser recuperada: oxidação, filtração, remoção de sais dissolvidos etc.;
- A análise técnico-econômica da viabilidade do reuso;
- O ajuste do programa de tratamento da água de recirculação do sistema de resfriamento.
O uso de água de reuso sem a avaliação correta pode levar a prejuízos, tais como falhas em equipamentos, aumento de manutenção, redução da produção, paradas de fábrica e, consequentemente, menor lucro.
Recomenda-se ainda que os projetos sejam orientados e/ou realizados por profissionais especializados tanto em tratamento de água como em processos de resfriamento. A Nalco Water é líder mundial no fornecimento de melhorias do tratamento de água e de processos. Com tecnologias, produtos e profissionais capacitados, os projetos de reuso desenvolvidos pela empresa garantem a qualidade da água e a integridade dos processos de resfriamento.
6. Referências Bibliográficas
BOHRER, P. – O risco oculto da água de reuso em sistemas de resfriamento. Documento interno. Nalco Water, 2019.
DANTAS, E. – Geração de vapor e Água de Refrigeração – Falhas – Tratamentos – Limpeza Química. Rio de Janeiro. 1992
EPA-Environmental Protection Agency. Guidelines for water reuse. Washington, D.C., 1992.
EPA-Environmental Protection Agency. Guidelines for water reuse. Washington, D.C., 2012.
ESLAMIAN, S. – Urban Reuse Water Handbook – CRC Press. 2016.
GENTIL, V. – Corrosão. 4. ed. Rio de Janeiro: LTC, 2003.
HESPANHOL, I. – Potencial de Reuso de Água no Brasil – Agricultura, Indústria, Municípios, Recarga de Aqüíferos. Revista Brasileira de Recursos Hídricos. Volume 7 n.4 – Out/Dez 2002, p.75-95.
MACHADO, I.A., – Tratamento terciário de efluentes de estações de tratamento por lodo ativado para fins de reúso como água de reposição em torres de resfriamento. Dissertação de mestrado. Escola Nacional de Saúde Pública. 145p. 2005.
PUCKORIUS, P. R.; LORETITSCH, G. A.; TVEDT, T. – Water Reuse in Refineries, Chemical Plants, and Utilities: Experiences Throughout the USA and Texas – Guidelines and Case Histories. In: Cooling Technology Institute Annual Conference, Corpus Christi TX – February 25-28, 2001. TP01-01: Cooling Technology Institute.

